Was ist die Basis-UDI-DI & Eudamed DI/ID?
Bedeutung & Struktur
05.06.25
Die Unique Device Identification (UDI) dient der eindeutigen Identifikation und Rückverfolgbarkeit von Medizinprodukten. Sie ist ein essenzieller Bestandteil der regulatorischen Anforderungen gemäß der MDR und wird in verschiedenen MDCG-Guidance-Dokumenten weiter spezifiziert.
Ein zentraler Bestandteil der UDI-Systematik ist die Basis-UDI, die in Verbindung mit der Basis-UDI-DI in regulatorischen Prozessen und der technischen Dokumentation verwendet wird. Bei Legacy devices wird statt einer Basic-UDI eine Eudamed-DI verwendet ( ggf. noch eine Eudmed-ID bei fehlender UDI-DI).
Dieser Überblick hilft Ihnen, die Zusammenhänge zwischen Basis-UDI, UDI und Eudamed DI/ID zu verstehen und die Anforderungen effizient umzusetzen und bestehende Entscheidungen zu überprüfen bevor falsche Information in Eudamed hochgeladen werden, die später gar nicht oder mit hohem Aufwand korrigiert werden können.
Was ist die Basis-UDI-DI und wie unterscheidet sie sich von der UDI?
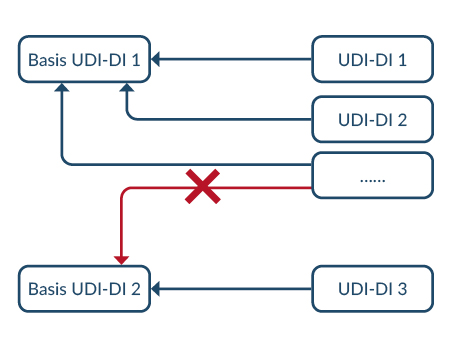
Die Basis-UDI-DI ist die primäre Kennung eines Produktes oder Produktgruppe. Sie ist das wichtigste Ordnungsmerkmal für Datensätze in der Eudamed Datenbank und ist auf einschlägigen Bescheinigungen und EU-Konformitätserklärungen zu finden. Sie wird oft mit Basis-UDI, BUDI abgekürzt oder der Global Model Number (GMN) gleichgestellt.
Die Basis-UDI-DI wird niemals auf dem Produkt selbst oder seinen Verpackungen aufgebracht.
Dabei muss jede UDI-DI nur einer Basis-UDI-DI zugeteilt sein. Daraus ergibt sich folgendes:
Die UDI wird dem Produkt selbst oder seiner Verpackung zugewiesen. Dabei verfügen höhere Verpackungsebenen über eine eigene UDI. Die UDI besteht aus UDI-DI und UDI-PI. Die UDI wird meist mit einem Strichcode und Klarschriftzeile aufgebracht. Die genaue Struktur und Bedeutung der UDI wird ins unserem Blogbeitrag: Was ist UDI-DI, UDI-PI & Direct Marking? Bedeutung & Struktur erklärt.
Sind noch Fragen offen?
Gerne unterstützen wir Sie bei Ihrem UDI/Eudamed Projekt oder bieten ihnen unsere RA Hotline an. Weitere wertvolle Informationen finden Sie in unserem Blogbeitrag: EUDAMED und Verordnung 2024/1860.
Wir helfen Ihnen gerne weiter. Sprechen Sie uns an.
Wer ist verantwortlich für die Basis-UDI
Der Hersteller ist verantwortlich und teilt jeder UDI-DI eine Basis-UDI-DI zu. Bei Systemen und Behandlungseinheiten kann es der legale Hersteller oder der „Zusammensetzer“ des System oder Behandlungseinheit sein (en: System and Proceure pack Producer (SPP)). Aus diesem Grund gibt es in Eudamed einen separaten Account für SPP. Dabei muss einem System oder Behandlungseinheiten eine eigene Basis-UDI und UDI zugeteilt werden. Dabei muss beachten werden das der SSP in bestimmte Fälle selbst zum Hersteller werden kann. Aus diesem Grund können Systeme oder Behandlungseinheiten als Hersteller oder SPP registriert werden. Genauere Angaben sind im Artikel 22 (MDR) & MDCG 2018-3 zu finden. Dabei muss sich der Hersteller/SPP bei Aufbau der Basis-UDI-DI an die Vorgaben der 4 zugelassene Zuteilungsstellen (GS1, HIBCC, IFA, ICCBBA) halten.
Wie ist die Basis-UDI aufgebaut?
Für die Erstellung einer Basis-UDI werden folgende Information benötigt

Dabei dürfen nicht mehr als 25 Zeichen für die Basis-UDI verwendet werden. Die Vorgaben der jeweiligen Zuteilungsstelle (GS1, HIBCC, IFA, ICCBBA) müssen ebenfalls beachten werden. Bei der Modelreferenz kann der Hersteller frei wählen, was er verwendet (aufsteigende Zahlen, Produktnamen, Abkürzungen, etc.) Er muss nur darauf achten welche Zeichen (meistens Sonderzeichen) die jeweilige Zuteilungsstelle erlaubt und welche nicht.
Welche Produkte können in einer Basis-UDI-DI zusammengefasst werden?
Die Zuteilungsstellen haben zwar Regeln für die Vergabe von Basis-UDI-DI und UDI-DI, aber es liegt beim Hersteller, das Produktportfolio so zu strukturieren, dass eine optimale Gruppierung erreicht wird. Dabei sind folgende Kriterien entscheidend:
Laut MDCG 2018-1 v4 können Produkte unter einer gemeinsamen Basis-UDI-DI zusammengefasst werden, wenn sie:
- die gleiche Zweckbestimmung haben,
- derselben Risikoklasse angehören und
- über gleiche Design- und Herstellungscharakteristika verfügen.
Dabei müssen z.B. weitere Parameter in Eudamed beachten werden. Medtech Europe hat in ihrem Guidance Dokument „Assigning Basic UDI-DI“ einen detaillierten Entscheidungsbaum erstellt, wann eine neue Basis-UDI nötig ist und wann nicht.
Wo taucht überall die Basis-UDI auf?
Die Basis-UDI wird in folgende Dokumente verwendet:
- EU-Konformitätserklärung
- Technische Dokumentation
- Kurzbericht über Sicherheit und klinische Leistung
- Vigilance und Post-Market Surveillance Reports (PSUR, ..)
- Freiverkaufszertifikate („FSC“)
- CE-Zertifikate
- Dokumente für klinische Prüfungen
- …
Was ist die Eudamed DI/ ID?
Die Eudamed-DI ist vergleichbar zur Basis-UDI. Sie wird aber nur bei „Legacy Devices“ in Eudamed verwendet.
Falls bei den „Legacy Devices“ eine UDI-DI vergeben wurde, wird bei der Erstellung der Eudamed-DI einfach ein „B-“vor die UDI-DI gesetzt. Dabei gibt es im Vergleich zur Basis-UDI nur eine 1:1 Beziehung zwischen UDI-DI und Eudamed-DI:
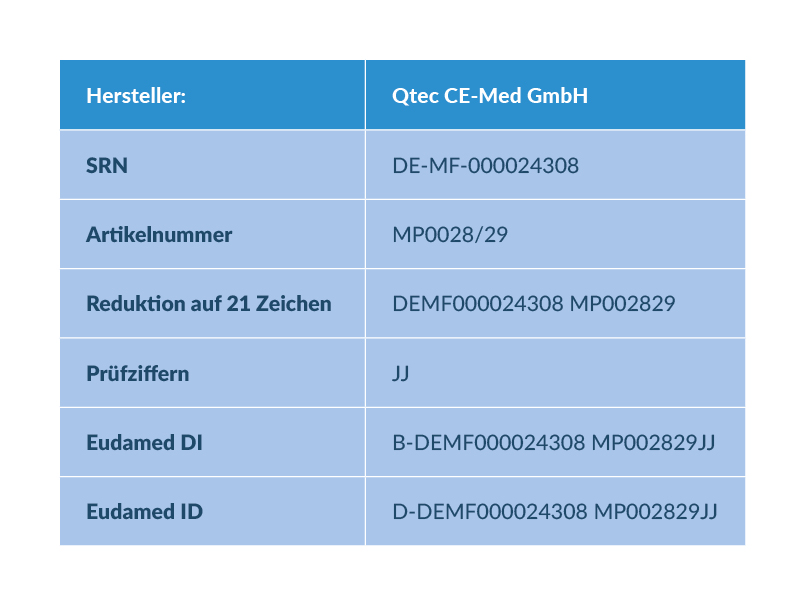
Falls keine UDI-DI vergeben wurde für das Legacy Device, vergibt der Hersteller eine Eudamed DI und Eudamed ID. Die Eudamed-ID ersetzt hier die fehlende UDI-DI. Die Eudamed ID besteht aus der SRN (Single Registation Number) (wird empfohlen) des Herstellers oder SPP, einer Artikelnummer und 2 Prüfziffern. Im Vergleich zur Eudamed DI wird bei der Eudamed ID statt „B-“ ein „D-“vorangesetzt. Dabei darf die SRN und Artikelnummer zusammen nicht mehr als 21 Zeichen lang sein (B- oder D- werden bei der Länge der Eudamed DI/ID mit einbezogen). Bei der Berechnung der Prüfziffer werden „B-“ oder „D“ nicht in die Berechnung mit einbezogen. Aus diesem Grund sind die Prüfziffern von Eudamed-DI und ID identisch.
In der unteren Tabelle ist eine mögliche Umsetzung dargestellt.
Ein weiteres Beispiel, sowie erlaubte Zeichen und die Berechnungsgrundlage der Prüfziffern sind im Eudamed Format of the Eudamed DI identificatio number zu finden. Beim Anlegen eines Legacy Devices in der Eudamed Datenbank, stellt Eudamed einen „Eudamed-DI Generator“ zu Verfügung Die Eudamed-ID wird dann automatisch erstellt und muss nicht mehr händisch eingetragen werden.