Clinical Affairs
Klinische Bewertung von Medizinprodukten unter der MDR
Die Klinische Bewertung von Medizinprodukten ist seit dem Inkrafttreten der Medical Device Regulation (EU) 2017/745 noch stärker in den Fokus von Behörden, Benannten Stellen und Medizinprodukteherstellern gerückt. Der klinische Nutzen wird stärker betont und es werden umfangreiche Daten (klinische Evidenz) gefordert, um Nutzen, Leistung und Sicherheit eines jeden Medizinproduktes nachzuweisen. Außerdem gelten stark verschärfte Anforderungen zum Beispiel für den Nachweis von Äquivalenz sowie die Qualifikationen der Autoren des Klinischen Bewertungsberichtes.
Insgesamt repräsentiert die Klinische Bewertung den Kerngedanken der MDR, eine sichere und leistungsgerechte Anwendung von Medizinprodukten zu gewährleisten. Der Klinische Bewertungsbericht stellt ein übergreifendes Dokument innerhalb der Technischen Dokumentation dar. Deshalb sollte die Klinische Bewertung von Medizinprodukten nicht als „notwendiges Übel“, sondern eher als wichtiger Beitrag angesehen werden, die Sicherheit und Leistungsfähigkeit eines jeden Medizinproduktes regelmäßig zu überprüfen und zu dokumentieren. Dabei ist es ratsam, bereits frühzeitig im Entwicklungsprozess damit zu beginnen.
Was sind die regulatorischen Voraussetzungen?
Artikel 5(2) der MDR fordert die Erfüllung der Grundlegenden Sicherheits- und Leistungsanforderungen (GSPR) gemäß Anhang I für jedes Medizinprodukt. Dies beinhaltet ebenfalls die Erstellung einer Klinischen Bewertung.
Die MDR definiert den Begriff „klinische Bewertung“ in Artikel 2 (44) wie folgt:
„Klinische Bewertung bezeichnet einen systematischen und geplanten Prozess zur kontinuierlichen Generierung, Sammlung, Analyse und Bewertung der klinischen Daten zu einem Produkt, mit dem Sicherheit und Leistung, einschließlich des klinischen Nutzens, des Produkts bei vom Hersteller vorgesehener Verwendung überprüft wird.“
Die Klinische Bewertung für Medizinprodukte ist also ein kontinuierlicher Prozess, der über den gesamten Lebenszyklus des Produktes die Sicherheit eines Medizinproduktes überprüft und die Leistungen und den Nutzen, die sich aus der Anwendung eines Medizinprodukt ergeben, gegen die resultierenden Risiken und die unerwünschten Nebenwirkungen abwägt. Ziel ist es letztendlich, die Vertretbarkeit des Nutzen-Risiko-Verhältnisses auf der Basis klinischer Daten nachzuweisen.
Die rechtliche Relevanz für die Klinische Bewertung ergibt sich aus Artikel 61 und Anhang XIV Teil A der MDR. Hersteller von Medizinprodukten aller Risikoklassen, die ihre Produkte in den EU-Mitgliedsstaaten vertreiben, sind verpflichtet, einen Klinischen Bewertungsbericht anzufertigen.
Wie in Artikel 61 (1) der MDR beschrieben, ist der erforderliche Umfang der klinischen Bewertung jedoch nicht für alle Medizinprodukte gleich:
„Der Hersteller spezifiziert und begründet den Umfang des klinischen Nachweises, der erforderlich ist, um die Erfüllung der einschlägigen grundlegenden Sicherheits- und Leistungsanforderungen zu belegen. Der Umfang des klinischen Nachweises muss den Merkmalen des Produkts und seiner Zweckbestimmung angemessen sein.“
Der Begriff „klinischer Nachweis“ ist hierbei nicht definiert. Sie als Hersteller eines Medizinproduktes müssen erkennen, was eine Klinische Bewertung für Ihr Produkt beinhalten soll, damit sie die Erfüllung der relevanten GSPR gemäß MDR Anhang I belegen können.
Wie führe ich eine klinische Bewertung durch?
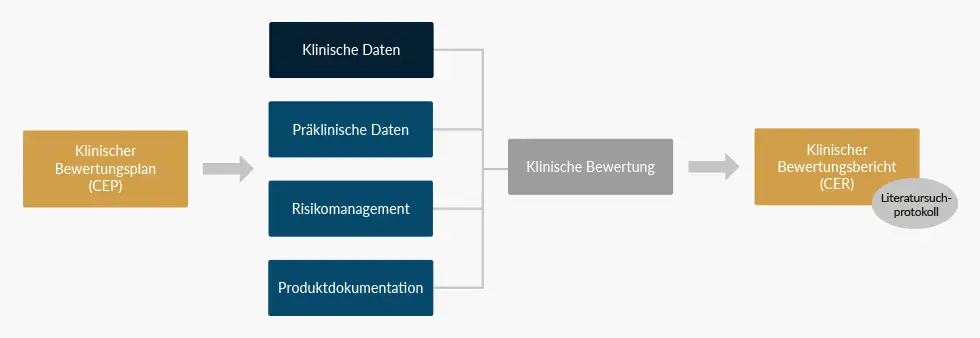
Eine Klinische Bewertung für ein Medizinprodukt basiert grundsätzlich auf klinischen Daten. Ausnahmen müssen entsprechend begründet werden. Wichtige Quellen für klinische Daten können hierbei Literatur, eigene Studien, Post-Market-Surveillance (PMS) oder Post-Market Clinical Follow-Up (PMCF) darstellen. Ergänzend werden z.B. präklinische Daten und weite Teile der Produktdokumentation herangezogen.
Eine starke Verzahnung von Klinischer Bewertung und Risikomanagement zur Bewertung von klinischen Risiken, (nicht-akzeptablen) Nebenwirkungen und dem Risiko-Nutzen-Verhältnis ist ebenfalls zu beachten. Jedes Medizinprodukt besitzt ein Risiko-Nutzen-Verhältnis. Bei diesem Risiko-Nutzen-Verhältnis muss der Nutzen das Risiko in jedem Fall überwiegen. Diese Abschätzung ist in vielen Fällen mehr, in anderen Fällen weniger eindeutig. Bei einem gewöhnlichen Skalpell scheint der Sachverhalt klar zu sein. Aber wie sieht es bei einem Laserskalpell aus? Überwiegt der Nutzen immer noch gegenüber dem potentiell gesteigerten Risiko? Entspricht das Gerät dem Stand der Technik?
Genau diesen Sachverhalt untersucht der Klinische Bewertungsbericht. Er analysiert das Nutzen-Risiko-Verhältnis und hinterfragt die Indikationen, die mit dem jeweiligen Medizinprodukt therapiert werden können. Hierbei werden alle relevanten Risiken dem Nutzen gegenübergestellt und mit dem aktuellen Stand der Technik verglichen. Daraus lässt sich ableiten, ob ein Medizinprodukt sicher und die beabsichtigte Therapie zeitgemäß ist. Die zentrale Fragestellung hierbei ist, ob es eine Alternative gibt, die zum gleichen Ergebnis führt – mit geringerem Risiko.
Eine systematische, wissenschaftliche Literaturrecherche ist im Allgemeinen ein wesentlicher Bestandteil einer Klinischen Bewertung, um klinische Daten für das Medizinprodukt und eventuelle äquivalente und/oder ähnliche Produkte zu identifizieren und zu analysieren, sowie den aktuellen Stand der Technik („State of the Art“) darzulegen. In Abhängigkeit von der Evidenz der identifizierten Literaturdaten, sowie der Risikoklasse und dem Innovationsgrad des Medizinproduktes, kann dann entschieden werden, wieviel eigene, vom Hersteller generierte klinische Daten, noch erforderlich sind. Daraus ergibt sich auch, ob eine klinische Prüfung notwendig ist. Diese Entscheidung muss entsprechend begründet werden.
Am Anfang der Klinischen Bewertung von Medizinprodukten steht der Klinische Bewertungsplan. Die Literaturrecherche wird in einem Literatursuchprotokoll dokumentiert und schließlich wird die Identifizierung, Bewertung und Analyse aller relevanten Daten im Klinischen Bewertungsbericht dokumentiert und zusammengefasst.
Die adäquate Bewerkstelligung dieser Aufgabe erfordert daher nicht nur regulatorische Kenntnisse, sondern auch ausreichende Erfahrung in der Erstellung von Klinischen Bewertungen für Medizinprodukte.
Zum Thema Literaturrecherche lesen Sie ebenfalls unseren Blogbeitrag „Klinische Bewertungen und Literaturrecherchen in Embase“
Welche Leitlinien sind für eine klinische Bewertung eines Medizinproduktes aktuell anwendbar?
Den Goldstandard zur Erstellung eines Klinischen Bewertungsberichts hat lange Zeit die MEDDEV-Leitlinie 2.7/1 Rev. 4 dargestellt. Und obwohl sie auf der MDD basiert, bildet sie weiterhin eine wichtige Grundlage für die Erstellung von Klinischen Bewertungen, vermutlich so lange bis die lange erwartete MDCG-Leitlinie für die Klinische Bewertung verfügbar sein wird. Zudem befindet sich ein neuer ISO-Standard (ISO/AWI 18969) in der Entwicklung, der den Prozess der klinischen Bewertung von Medizinprodukten spezifizieren soll. Allerdings wird eine Veröffentlichung dieses Standards nicht vor 2025 erwartet.
Diverse MDCG-Leitlinien, an denen man sich für spezifische Fragestellungen oder Produktgruppen orientieren kann, gibt es allerdings bereits. Hervorzuheben sind hier z.B. die MDCG 2020-5 „Equivalence“, MDCG 2020-6 „Legacy devices“ und MDCG 2020-13 „Clinical Evaluation Assessment Report Template“.
Es wird also klar, dass noch nicht alle Lücken geschlossen und alle Fragestellungen geklärt sind. Umso wichtiger ist es, wissenschaftlich fundiert und nachvollziehbar zu arbeiten und eine gute Übersicht zu behalten, welchen Anforderungen der Klinische Bewertungsbericht genügen muss.
Hierbei stehen wir Ihnen mit unserem Clinical Affairs Experten-Team gerne zur Seite, sei es für die Beantwortung spezifischer Fragestellungen, die Planung und Durchführung von Literatursuchen oder die Erstellung von kompletten Klinischen Bewertungen für alle Arten von Medizinprodukten. Wir freuen uns auf Ihre Anfrage.
Unsere Experten zum Thema Klinische Bewertung von Medizinprodukten
In unserem Team haben wir zwei ausgewiesende Experten, die ihr Fachwissen und ihre jahrelange Erfahrung gerne mit Ihnen teilen.

Prof. Dr. Michael Imhoff
Prof. Dr. Michael Imhoff ist Facharzt für Allgemeinchirurgie und Intensivmedizin und bringt über 20 Jahre Erfahrung als unabhängiger Berater im Bereich Medizintechnik mit. Er war über neun Jahre als Oberarzt Leiter einer Intensivstation und hat sich im Bereich mediszinische Informatik und Statistik habilitiert. Außerdem blickt er auf 18 Jahre klinische Erfahrung in einem tertiären Referenzzentrum in Deutschland zurück. Bei qtec bietet er als Medical Clinical Director medizinisch-wissenschaftliche Unterstützung und schult in der qtec Academy unter anderem Medizinproduktehersteller, Pharmaunternehmen und Behörden im Bereich klinische Bewertung von Medizinprodukten sowie in der Literatursuche und bei klinischen Studien.

Dr. Bombien
News
Strategische und regulatorische Aspekte für Kombinationsprodukte
Erfahre, wie Kombinationsprodukte regulatorisch korrekt zur Notified Body Opinion geführt werden – von PMOA-Bewertung bis MDR-konformer Dokumentation.
Die Haftung der PRRC
Sichern Sie Ihre regulatorische Compliance mit unserer professionellen externen PRRC – rechtssicher, erfahren und entlastend.Fokusthema: Biologische Sicherheit
Tauchen Sie ein in die spannende Welt der Biokompatibilität und Toxikologischen Charakterisierung.Der qtec Solution Cube: Mehrdimensional denken, effektiv handeln
Der qtec Solution Cube macht komplexe MedTech-Dienstleistungen greifbar. Erfahren Sie im Blog mehr dazu.