Die neue Medizinprodukte-Betreiberverordnung (MPBetreibV): Wichtige Änderungen für Hersteller und Medizinprodukteberater
Die Medizinprodukte-Betreiberverordnung (MPBetreibV) legt in Deutschland die gesetzlichen Anforderungen für das Errichten, Betreiben, Benutzen und Instandhalten von Medizinproduk-ten fest. Aufgrund technischer Entwicklungen, regulatorischer Anpassungen und praktischer Herausforderungen wurde die Verordnung überarbeitet.
Die Neuerungen betreffen insbesondere die Aufbereitung von Einmalprodukten, sicherheits-technische und messtechnische Kontrollen sowie IT-Sicherheitsanforderungen für vernetzte Medizinprodukte.
Die wichtigsten Änderungen betreffen:
- IT-Sicherheitsanforderungen für vernetzte Produkte (§ 17)
- Erweiterte Anforderungen an sicherheits- und messtechnische Kontrollen (§ 12 & § 15)
- Neue Dokumentationspflichten für Betreiber (§ 13 & § 14)
- Neue Vorgaben zur Wiederaufbereitung von Einmalprodukten (§ 8 & § 9)
- Sonderregelungen für Altgeräte nach der alten MedGV (§ 21)
Diese Änderungen wirken sich direkt auf Hersteller, Betreiber und Medizinprodukteberater aus – insbesondere im Bereich Dokumentation, Kontrolle und Instandhaltung.
- Änderungen der MPBetreibV im Detail
- Exkurs: Verzögerung der MPBetreibV
- Die wichtigsten Änderungen im Überblick
- § 1 – Anwendungsbereich
- § 2 – Begriffsbestimmungen
- § 12 – Anpassung der sicherheitstechnischen Kontrollen (STK)
- § 13 – Dokumentationspflichten für Betreiber
- § 14 – Neue Anforderungen an Bestandsverzeichnisse
- § 15 – Anpassung der messtechnischen Kontrollen (MTK)
- § 17 – Neue Anforderungen an Software als Medizinprodukt
- § 21 – Anforderungen für Altgeräte
- § 8 und § 9 Anforderungen für die Aufbereitung
- Auswirkungen für Hersteller
- Auswirkungen für Medizinprodukteberater
- Auswirkungen für Betreiber
- Fazit
Änderungen der MPBetreibV im Detail
Mit Wirkung zum 20. Februar 2025 sind umfassende Änderungen der Medizinprodukte-Betreiberverordnung (MPBetreibV) in Kraft getreten. Die Anpassungen betreffen insbesondere die die Wiederaufbereitung von Einmalprodukten, Prüfpflichten für sicherheitskritische Medizinprodukte und IT-Sicherheitsanforderungen für Software.
Wichtige Änderungen und neue Anforderungen:
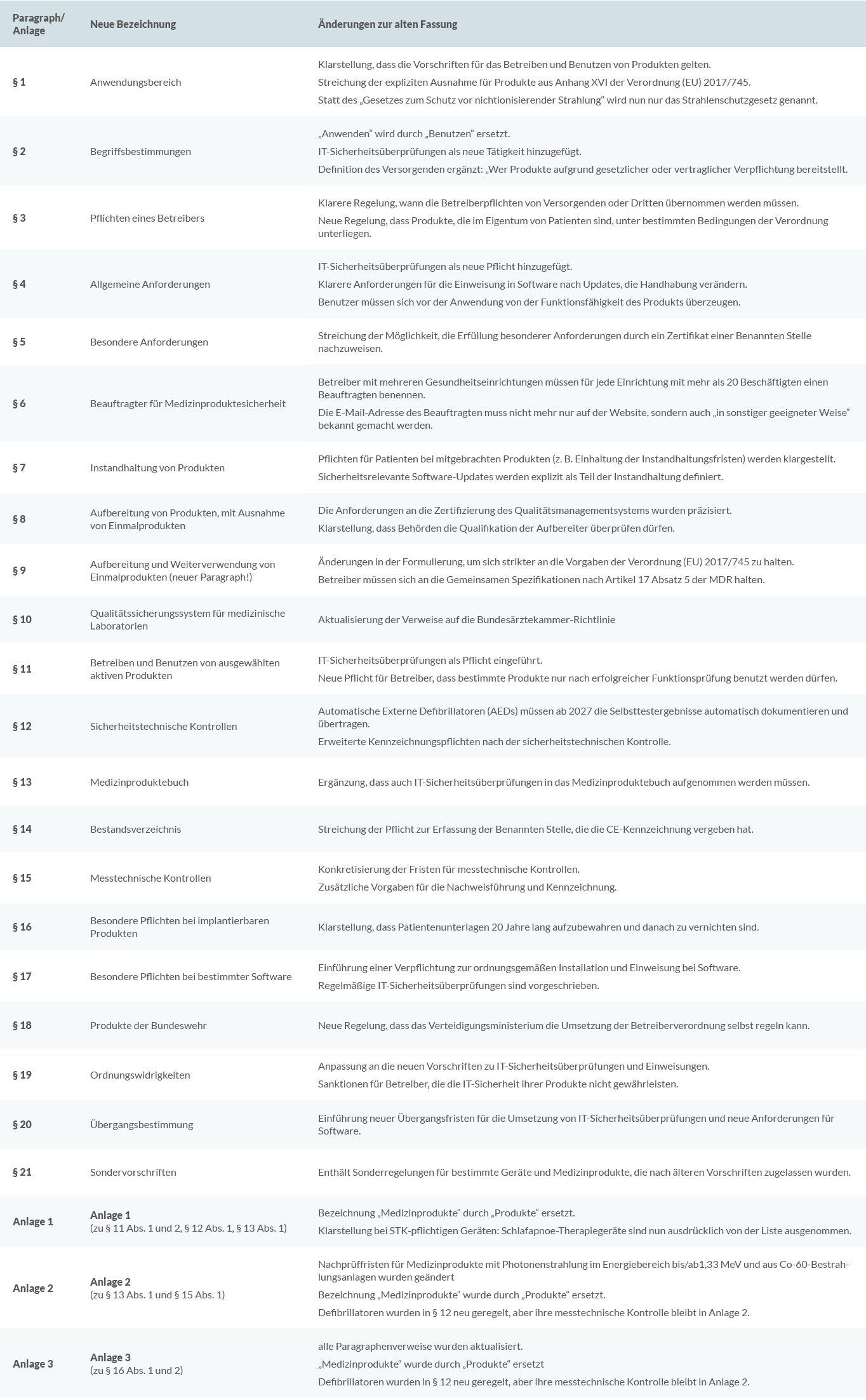
- § 1 – Anwendungsbereich: Begriffsänderung von „Anwenden“ zu „Benutzen“ zur regulatorischen Klarstellung.
- § 8 & § 9 – Aufbereitung von Einmal- & Mehrwegprodukten: Neue Anforderungen nach MDR & EU-Durchführungsverordnung.
- § 12 – Erweiterung der sicherheitstechnischen Kontrollen (STK): Neue Prüfplichten, u. a. für AEDs.
- § 13 – Dokumentationspflichten für Betreiber: IT-Sicherheitsüberprüfungen müssen dokumentiert werden.
- § 14 – Neue Anforderungen an Bestandsverzeichnisse: Vernetzte Medizinprodukte müssen erfasst werden.
- § 15 – Anpassung der messtechnischen Kontrollen (MTK): Neue Ausnahmen für bestimmte Geräte.
- § 17 – Neue IT-Sicherheitsanforderungen für bestimmte Software.
- § 21 – Verschärfte Anforderungen für Altgeräte nach der Medizingeräteverordnung (MedGV).
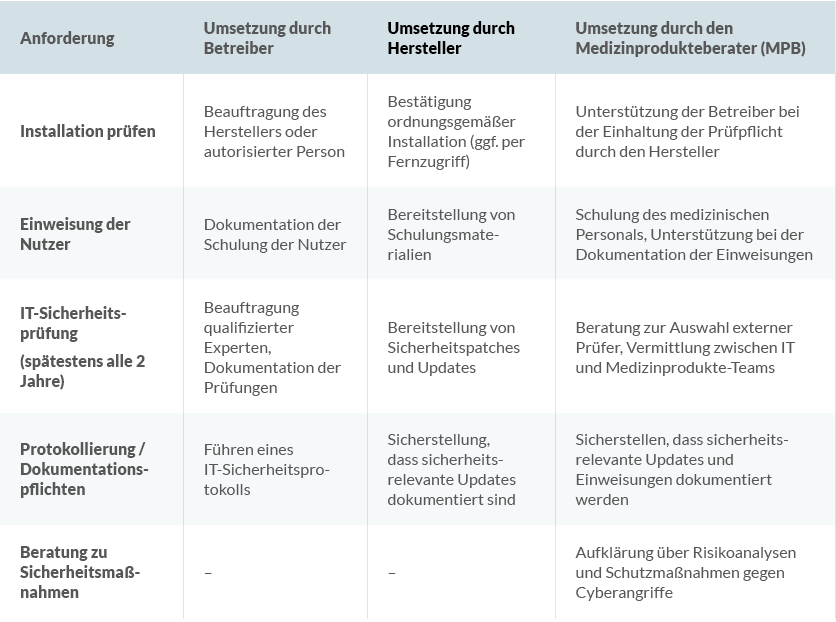
Hinweis für Medizinprodukteberater: Betreiber sollten frühzeitig geschult werden, da die neuen Anforderungen eine erweiterte Dokumentationspflicht und technische Validierung erfordern.
Exkurs: Verzögerung der MPBetreibV
Ursprünglich hatte der Bundesrat die überarbeitete MPBetreibV bereits im Juli 2024 verabschiedet. Allerdings geriet das Verfahren ins Stocken, da der neue § 9 zur Wiederaufbereitung von Einmalprodukten auf erheblichen Widerstand stieß. Die geplante Regelung sah ein Verwendungsverbot für bestimmte aufbereitete Medizinprodukte vor, was insbesondere Wiederaufbereiter unerwartet traf.
Nach intensiven Nachverhandlungen wurde die Verordnung überarbeitet. Der gültige § 9 erlaubt nun die Wiederaufbereitung unter strengen Auflagen, sofern die Vorgaben der MDR und der Durchführungsverordnung (EU) 2020/1207 erfüllt werden.
Die wichtigsten Änderungen im Überblick
§ 1 - Anwendungsbereich
„Anwenden“ wurde durch „Benutzen“ ersetzt, um die regulatorische Abgrenzung zu verdeutlichen
Neue Klarstellung: Die Vorschriften gelten auch für IT-Sicherheitsüberprüfungen und Netzwerksicherheit
Wichtig: Gebrauchsanweisungen müssen diese neuen Begriffe korrekt wiedergeben. Medizinprodukteberater sollten Betreiber darauf hinweisen, dass auch digitale Infrastruktur-Anforderungen zur Betreiberpflicht gehören.
§ 2 – Begriffsbestimmungen
Neue Anforderungen für IT-Sicherheit und Betreiberpflichten aufgenommen
Wichtig: Hersteller müssen sicherstellen, dass ihre Produkte den neuen IT-Sicherheitsanforderungen entsprechen. Dazu gehört u. a. die Implementierung validierter Sicherheitsmechanismen für vernetzte Produkte.
§ 12 – Anpassung der sicherheitstechnischen Kontrollen (STK)
Präzisierung der STK-Pflichten: Schlafapnoe-Therapiegeräte sind nun ausdrücklich von der STK-Pflicht ausgenommen. Andere aktive Medizinprodukte wie Defibrillatoren, Beatmungsgeräte (außer Schlafapnoe-Therapiegeräte), Hochfrequenz-Chirurgiegeräte, Bildgebungsgeräte und Säuglingsinkubatoren bleiben weiterhin STK-pflichtig.
Automatische Externe Defibrillatoren (AEDs): Ab dem 1. Januar 2027 müssen AEDs regelmäßig ihre Selbsttest-Ergebnisse automatisch an den Betreiber übermitteln.
Dokumentationspflicht: Betreiber müssen den Standort, die Funktionsfähigkeit und die öffentliche Zugänglichkeit von AEDs erfassen und dokumentieren.
§ 13 – Dokumentationspflichten für Betreiber
IT-Sicherheitsüberprüfungen müssen in das Medizinproduktebuch aufgenommen werden
Wichtig: Hersteller müssen sicherstellen, dass die notwendigen Informationen bereitge-stellt werden. Medizinprodukteberater sollten Betreiber bei der Umsetzung beraten.
§ 14 – Neue Anforderungen an Bestandsverzeichnisse
Vernetzte Medizinprodukte müssen im Bestandsverzeichnis dokumentiert werden
Wichtig: Hersteller von vernetzten Produkten müssen sicherstellen, dass sie relevante In-formationen bereitstellen. Medizinprodukteberater sollten Betreiber bei der Einhaltung unter-stützen.
§ 15 – Anpassung der messtechnischen Kontrollen (MTK)
Nichtinvasive Blutdruckmessgeräte, die für Laien vorgesehen sind, sind unter bestimmten Bedingungen von der MTK-Pflicht befreit.
Betreiber können sich künftig auf Herstellerbescheinigungen oder Gutachten stützen, um die Einhaltung der Messgenauigkeit nachzuweisen.
§ 17 – Neue Anforderungen an Software als Medizinprodukt
Verpflichtende IT-Sicherheitsüberprüfungen für alle vernetzten Medizinprodukte.
Dokumentationspflicht für Software-Installationen und sicherheitsrelevante Updates.
Betreiber müssen sicherstellen, dass nach sicherheitsrelevanten Updates eine erneute Einweisung erfolgt, falls sich die Nutzung des Produkts dadurch wesentlich verändert.
Erhöhte Cybersicherheit für Medizinprodukte.
Hieraus ergeben sich neue Anforderungen, bei denen alle Akteure involviert sind:
§ 21 – Anforderungen für Altgeräte
- Nachweispflicht für Betreiber: Altgeräte dürfen nur weiter betrieben werden, wenn nachge-wiesen wird, dass sie den aktuellen Sicherheits- und Leistungsanforderungen entsprechen.
- Regelmäßige sicherheitstechnische (STK) und messtechnische Kontrollen (MTK) für solche Geräte sind nun verpflichtend, sofern sie noch genutzt werden.
- Erweiterte Dokumentationspflichten: Betreiber müssen lückenlos dokumentieren, welche Prüfungen durchgeführt wurden und dass das Gerät noch sicher betrieben werden kann.
- Stilllegungspflicht für nicht-konforme Geräte: Falls kein gültiger Nachweis über die Sicher-heit des Altgeräts erbracht werden kann, muss es außer Betrieb genommen werden.
Strengere Anforderungen für ältere Geräte bringen mehr Sicherheit, aber auch erhöhten Prüfaufwand für Betreiber.
- Validierung der Aufbereitungsprozesse:
- Die Reinigungs-, Desinfektions- und Sterilisationsverfahren müssen validiert werden.
- Jede Aufbereitung muss dokumentiert werden – insbesondere für Hochrisiko-Produkte.
- Die Leistungsfähigkeit des wiederaufbereiteten Produkts darf nicht schlechter sein als im Neuzustand.
- Zertifizierte Qualitätssicherung:
- Gesundheitseinrichtungen, die Einmalprodukte aufbereiten, müssen ein zertifiziertes Qualitätsmanagementsystem (QMS) implementieren.
- Externe Aufbereiter müssen regelmäßig von einer Benannten Stelle auditiert werden.
- Kennzeichnung und Rückverfolgbarkeit:
- Jedes aufbereitete Einmalprodukt muss eindeutig identifizierbar sein.
- Betreiber müssen sicherstellen, dass die Produkte nicht in andere Gesundheitseinrichtungen weiterverkauft werden.
- Restriktionen für Hochrisiko-Produkte:
- Hochrisiko-Produkte, wie katheterbasierte Implantate oder invasive chirurgische Einmalinstrumente, können in vielen Fällen nicht sicher wiederaufbereitet werden und bleiben von der Wiederverwendung ausgeschlossen.
- Eine Liste der nicht aufbereitbaren Produkte könnte durch eine ergänzende EU-Verordnung oder nationale Regelungen festgelegt werden.
Auswirkungen für Hersteller
Für Hersteller von Medizinprodukten bringt die neue Verordnung eine Erweiterung der Anforderungen an Gebrauchsanweisungen, Instandhaltungsmaßnahmen und Sicherheitsnachweise.
Besonders betroffen sind Hersteller von Einmalprodukten, da deren Wiederverwendung nun unter bestimmten Bedingungen erlaubt ist.
- Erhöhte Anforderungen an Nachweise für Wartung und Instandhaltung: Hersteller müssen detaillierte Prüfprotokolle für sicherheitstechnische und messtechnische Kontrollen bereitstellen (§ 12, § 15).
- Spezifische Kennzeichnungspflichten für aufbereitete Einmalprodukte: Hersteller müssen klare Anweisungen zur Wiederaufbereitung und Kennzeichnung der wiederverwendeten Produkte liefern (§ 9).
Ein weiterer kritischer Punkt ist die gestiegene Verantwortung im Bereich IT-Sicherheit. Hersteller von Software als Medizinprodukt müssen nachweisen, dass ihre Systeme den neuen Anforderungen entsprechen. Die MPBetreibV schreibt nun vor, dass Softwareinstallationen und Updates lückenlos dokumentiert und sicherheitskritische Aktualisierungen regelmäßig geprüft werden müssen. Zudem werden vernetzte Medizinprodukte strikter reguliert, um Manipulationen oder Cyberangriffe zu verhindern.
Wichtige Maßnahmen für Hersteller:
- Gebrauchsanweisungen überarbeiten, um den neuen Anforderungen an Wartung, Aufbereitung und IT-Sicherheit gerecht zu werden.
- Nachweise für Instandhaltungs- und Sicherheitsprüfungen bereitstellen.
- Kennzeichnungsvorgaben für aufbereitete Einmalprodukte beachten (§ 9).
- Sicherstellen, dass Softwareprodukte IT-Sicherheitsprüfungen bestehen und Update-Prozesse dokumentiert sind.
Unsere Fortbildungen
Sie möchten mehr erfahren? Dann buchen Sie das passende Seminar zum Thema. Oder benötigen sie eine Inhouse-Schulung? Dann kontaktieren Sie uns gerne unter academy@qtec-group.com
Auswirkungen für Medizinprodukteberater
Für Medizinprodukteberater eröffnen sich mit der neuen MPBetreibV erweiterte Tätigkeitsfelder, da Betreiber verstärkt Unterstützung bei der Umsetzung der neuen Anforderungen benötigen.
Ein besonderer Schwerpunkt liegt auf der Schulung von Betreibern und Anwendern. Medizinprodukteberater müssen sicherstellen, dass die neuen Vorschriften zur Instandhaltung, Wiederverwendung von Einmalprodukten und IT-Sicherheit korrekt umgesetzt werden.
Ein weiteres wichtiges Feld ist die Begleitung bei der Umsetzung der neuen Prüfintervalle für STK und MTK. Betreiber müssen über die geänderten Fristen informiert werden und benötigen möglicherweise Unterstützung bei der Dokumentation.
- Beratung zur Betriebserlaubnis älterer Geräte: Betreiber müssen nachweisen, dass Altgeräte, die nach den Vorschriften der MedGV (bis 2001) in Verkehr gebracht wurden, weiterhin den aktuellen Sicherheitsstandards entsprechen (§ 21).
- Schulungen zu neuen sicherheitstechnischen Anforderungen für Betreiber: Insbesondere für die Umsetzung der erweiterten Prüfpflichten und IT-Sicherheitsmaßnahmen erforderlich.
Mit den neuen Anforderungen an vernetzte Medizinprodukte steigt auch der Beratungsbedarf im Bereich IT-Sicherheit. Medizinprodukteberater fungieren immer häufiger als Schnittstelle zwischen Herstellern und Betreibern, um Softwarelösungen sicher zu implementieren und IT-Sicherheitsanforderungen einzuhalten.
Wichtige Maßnahmen für Medizinprodukteberater:
- Schulungen für Betreiber anbieten, um die neuen Anforderungen an Instandhaltung und IT-Sicherheit zu vermitteln.
- Betreiber bei der Umsetzung der STK- und MTK-Pflichten unterstützen, insbesondere bei neuen Prüfintervallen.
- IT-Sicherheitsberatung ausbauen → Unterstützung bei der Einführung neuer Software- und Vernetzungsanforderungen.
- Unterstützung von Betreibern bei der Einhaltung der neuen Anforderungen für Altgeräte (§ 21).
Auswirkungen für Betreiber
Für Betreiber – darunter Krankenhäuser, Arztpraxen und andere Gesundheitseinrichtungen – ergeben sich aus der MPBetreibV neue Pflichten und Verantwortlichkeiten.
Ein zentrales Thema ist die erweiterte Instandhaltungspflicht. Betreiber müssen sicherstellen, dass Wartungen, Reparaturen und sicherheitsrelevante Softwareupdates vollständig dokumentiert werden. Die neuen Vorgaben schreiben vor, dass bei sicherheitskritischen Updates eine erneute Einweisung der Nutzer erforderlich ist, wenn sich die Handhabung des Produkts dadurch verändert.
- Dokumentationspflicht für Altgeräte nach der alten MedGV (bis 2001): Betreiber müssen für ältere Medizinprodukte nachweisen, dass sie weiterhin sicher betrieben werden können (§ 21).
- Verschärfte Auflagen für die Wiederaufbereitung von Einmalprodukten: Betreiber dürfen aufbereitete Produkte nur nutzen, wenn der Prozess MDR-konform ist und die verwendeten Produkte eindeutig als aufbereitet gekennzeichnet sind (§ 9).
Besonders relevant sind die neuen Vorschriften zur Wiederverwendung von Einmalprodukten. Betreiber dürfen aufbereitete Einmalprodukte nur verwenden, wenn der Aufbereitungsprozess den Vorgaben der MDR entspricht. Das bedeutet, dass sie sich auf zertifizierte Aufbereiter verlassen müssen und deren Prozesse regelmäßig überprüfen. Die Umsetzung dieser Vorgaben erfordert eine enge Zusammenarbeit mit den Herstellern und Medizinprodukteberatern.
Darüber hinaus wurden die Anforderungen an sicherheitstechnische (STK) und messtechnische Kontrollen (MTK) verschärft:
- Automatische Externe Defibrillatoren (AEDs) müssen ab 2027 ihre Selbsttest-Ergebnisse automatisch an den Betreiber übermitteln.
- Nichtinvasive Blutdruckmessgeräte für Laien sind von der MTK-Pflicht befreit, sofern der Hersteller garantieren kann, dass die Messgenauigkeit über die gesamte Nutzungsdauer eingehalten wird.
Betreiber müssen sich auf zusätzlichen administrativen Aufwand einstellen, insbesondere im Bereich Dokumentation und Sicherheitsnachweise.
Wichtige Maßnahmen für Betreiber:Neue Prüfpflichten umsetzen: Wartungen und Softwareupdates müssen lückenlos dokumentiert werden.
- Prüfintervalle für STK und MTK einhalten und neue Anforderungen an AEDs umsetzen.
- Sicherstellen, dass die Wiederaufbereitung von Einmalprodukten nach MDR-Richtlinien erfolgt.
- Schulungen für Anwender einplanen, wenn sicherheitskritische Updates die Handhabung eines Medizinprodukts verändern.
- Dokumentationspflichten für Altgeräte beachten: Betreiber müssen sicherstellen, dass Geräte aus der alten MedGV-Ära nachweislich sicher betrieben werden können (§ 21)
Fazit
Die überarbeitete MPBetreibV bringt erweiterte Sicherheits- und Kontrollpflichten, neue Betreiberverantwortungen und klare Vorgaben zur Wiederaufbereitung von Einmalprodukten.
- Hersteller müssen ihre Dokumentation und Prozesse überarbeiten.
- Medizinprodukteberater spielen eine Schlüsselrolle in Schulung und Umsetzung der neuen Vorgaben und sollten ihre Expertise in den Bereichen IT-Sicherheit und Prüfpflichten weiterentwickeln.
- Betreiber tragen mehr Verantwortung für Instandhaltung, Wartung und IT-Sicherheit und müssen verstärkt auf eine lückenlose Dokumentation achten.
Neue Dokumentationspflichten für Altgeräte nach der alten MedGV (bis 2001) erhöhen den Prüfaufwand für Betreiber.
Die verschärften Anforderungen an sicherheitstechnische und messtechnische Kontrollen bringen mehr Sicherheit, aber auch mehr administrative Verpflichtungen mit sich.
Die Änderungen stellen nicht nur Herausforderungen dar, sondern bieten auch Chancen zur Optimierung von Prozessen und zur Verbesserung der Patientensicherheit. Hersteller, Betreiber und Medizinprodukteberater sollten sich daher frühzeitig mit den neuen Vorschriften vertraut machen, um eine reibungslose Umsetzung sicherzustellen.