Vom MPG zum MPDG
Was sich im Medizinprodukterecht geändert hat
Mit der Einführung der EU-Verordnungen MDR (EU) 2017/745 und IVDR (EU) 2017/746 hat sich der Rechtsrahmen für Medizinprodukte in Europa grundlegend gewandelt. In Deutschland wurde das bisherige Medizinproduktegesetz (MPG) durch das Medizinprodukterecht-Durchführungsgesetz (MPDG) ersetzt. Dieser Übergang markiert mehr als nur einen formalen Akt – er brachte zahlreiche Änderungen mit sich. Und genau darum geht es in diesem Blogbeitrag:
Warum wurde das MPDG eingeführt?
Das MPDG wurde eingeführt, um die nationale Umsetzung der EU-Verordnungen MDR und IVDR zu regeln. Diese Verordnungen gelten unmittelbar in allen EU-Mitgliedstaaten und benötigen daher keine nationale Umsetzung wie frühere Richtlinien. Dennoch bleiben bestimmte Regelungsbereiche offen, die national ausgestaltet werden müssen – etwa die Benennung zuständiger Behörden, die Festlegung von Straf- und Bußgeldvorschriften oder landesspezifische Anforderungen, die im Einklang mit dem EU-Recht stehen müssen.
Das MPDG ersetzt das frühere MPG vollständig und wurde als Teil des Medizinprodukte-Anpassungsgesetzes-EU (MPAnpG-EU) eingeführt. Es schafft den rechtlichen Rahmen, um die MDR und IVDR in Deutschland wirksam und vollziehbar umzusetzen.
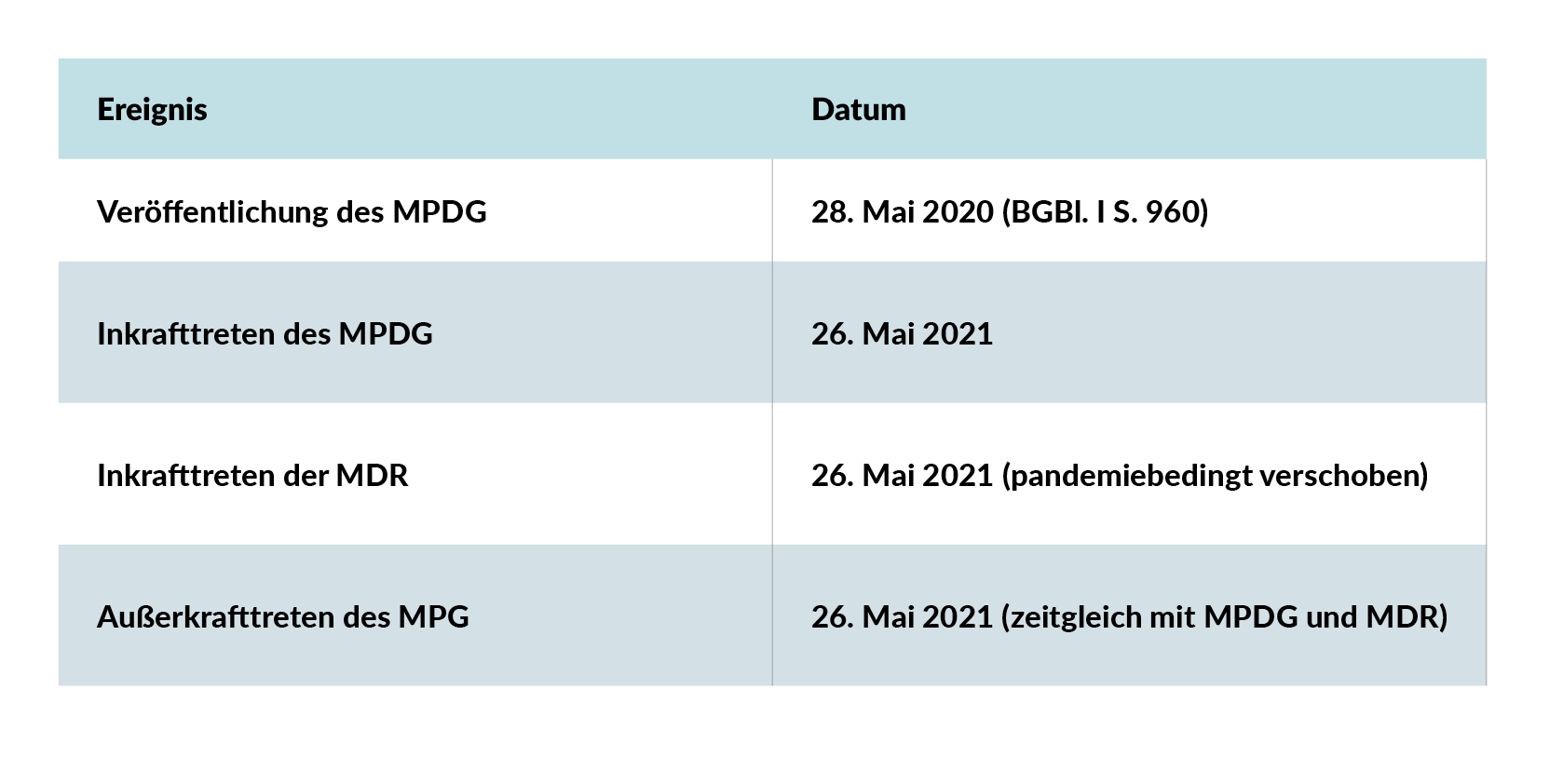
Der Übergang vom MPG zum MPDG – wichtige Termine
Mit dem 26. Mai 2021 trat das MPDG in Kraft und das MPG trat außer Kraft. Gleichzeitig wurde die MDR wirksam. Dieser Stichtag markierte den Beginn einer neuen Ära im deutschen Medizinprodukterecht. Das MPDG ergänzt die EU-Vorgaben durch nationale Regelungen – etwa zu Zuständigkeiten, Verfahren und Sanktionen – und schafft damit einen verbindlichen Rahmen für die Umsetzung in Deutschland.
Wichtige Termine im Überblick:
Mit diesem Stichtag wurde das MPDG zur neuen nationalen Grundlage für das Medizinprodukterecht in Deutschland – im Zusammenspiel mit MDR und IVDR.
Inhalte von MPG und MPDG im Überblick
Die nachstehende Tabelle zeigt zentrale Unterschiede und Neuerungen zwischen MPG und MPDG. Der Fokus liegt dabei auf der Übernahme bestehender Regelungen sowie auf den neu eingeführten Anforderungen.
Was regelte das MPG?
Umsetzung der alten EU-Richtlinien:
- (90/385/EWG (aktive implantierbare Medizinprodukte)
- 93/42/EWG (allgemeine Medizinprodukte)
- 98/79/EG (in-vitro-Diagnostika)
Was regelt das MPDG (auch)?
Umsetzung & Ergänzung der MDR und IVDR im nationalen Recht
Was ist neu im MPDG?
Erweiterter Anwendungsbereich auf Nicht-Medizinprodukte, die aber mit der Zweckbestimmung eines Medizinproduktes verwendet werden (MPDG, § 2)
Was regelte das MPG?
44 Paragraphen, gegliedert in Abschnitte
Was regelt das MPDG (auch)?
99 Paragraphen, 10 Kapitel
Was ist neu im MPDG?
Neue Systematik, zusätzliche Kapitel zu Sondervorschriften und Übergangsregelungen
Was regelte das MPG?
Inverkehrbringen, Inbetriebnahme und Betreiben von Medizinprodukten;
- Verantwortlichkeiten von Herstellern, Betreibern und Anwendern;
- Vigilanzsystem;
- Aufgaben des Sicherheitsbeauftragten und Medizinprodukteberater
- Zuständigkeiten und Sanktionsmöglichkeiten für Behörden
- Grundlegende Anforderungen an Studien mit Medizinprodukten
Was regelt das MPDG (auch)?
Grundsätzlich übernommen
Was ist neu im MPDG?
Ergänzung und Detaillierung gemäß MDR/IVDR, Sicherheitsbeauftragter entfällt
Was regelte das MPG?
Grundlegende Anforderungen an Studien mit Medizinprodukten
Was regelt das MPDG (auch)?
Beibehaltung von Anforderungen; Ergänzung zur MDR
Was ist neu im MPDG?
Kapitel 4 umfasst 47 Paragrafen mit zahlreichen Neuregelungen:
- Positives Votum der Ethikkommission vor Genehmigung der klinischen Prüfung durch das BfArM erforderlich (§31 MPDG), abhängig von Risikoklasse
- Anträge über EUDAMED (für die Genehmigung durch das BfArM) und das Deutsche Medizinprodukte-Informations- und Datenbanksystem (DMIDS) (für das Votum der Ethikkommission) einzureichen
- §26 MPDG verpflichtet zur Versicherungspflicht des Sponsors für Probanden bei möglichem Schadensersatz
- §47 MPDG regelt sonstige klinische Prüfungen: Anzeige- statt Genehmigungspflicht bei wissenschaftlichen Studien mit einem nicht-CE-zertifizierten Medizinprodukt, jedoch positives Ethikvotum erforderlich; beides entfällt vollständig bei wissenschaftlichen Studien für CE-Medizinprodukte
- Datenschutzrechtliche Anforderungen: Pseudonymisierung personenbezogener Daten durch Prüfer
- Anforderungen gelten auch bei rein wissenschaftlichem Erkenntnisinteresse
- Verschärfte Auflagen bei besonderen Probanden (Minderjährige, Gefangene etc.)
- Präzisierte Interaktion mit Ethikkommission
Was regelte das MPG?
Primär Länderbehörden zuständig für Marktüberwachung
Was regelt das MPDG (auch)?
Erweiterte Zuständigkeit für BfArM & PEI
Was ist neu im MPDG?
Bundesoberbehörden können Maßnahmen bei Risiken ergreifen, die von einem Medizinprodukt ausgehen, Produkte zurückrufen/aus dem Markt nehmen, die Bereitstellung, das Betreiben oder Anwenden untersagen oder einzuschränken und Öffentlichkeitsarbeit betreiben (§38, §45 MPDG)
Was regelte das MPG?
Freiheitsstrafe bis 3 Jahre, Bußgeld bis 30.000 €
Was regelt das MPDG (auch)?
Grundsätzlich erhalten
Was ist neu im MPDG?
Freiheitsstrafe von 1-10 Jahre, neue Tatbestände (z. B. bei Inverkehrbringen von gefälschten Produkten)
Was regelte das MPG?
Pflicht zur Sachkenntnis, Meldeverantwortung
Was regelt das MPDG (auch)?
§ 83 MPDG enthält klare Vorgaben zur Qualifikation, Schulung und Meldepflicht
Was ist neu im MPDG?
Präzisierte Voraussetzungen zur Sachkenntnis; differenzierte Nachweispflicht; Schulungsverpflichtung des Auftraggebers; explizite Aufzeichnungs- und Übermittlungspflichten
Was regelte das MPG?
Pflichtrolle mit Meldeverantwortung § 30 MPG
Was regelt das MPDG (auch)?
Nicht mehr vorgesehen
Was ist neu im MPDG?
Gesetzlich nicht mehr vorgesehen; Aufgaben wurden im Rahmen der MDR neu strukturiert (Art. 15 MDR: PRRC); Pflicht zur internen Zuweisung entsprechender Verantwortung bleibt über EU-Recht bestehen
Was regelte das MPG?
Begleitmaterialien in deutscher Sprache
Was regelt das MPDG (auch)?
Fortgeführt
Was ist neu im MPDG?
Ausnahmen für professionelle Anwender (Englisch); Kennzeichnungspflicht für Vorführgeräte, wenn die Anforderungen der Verordnung nicht genügen.
Was regelte das MPG?
Geregelt durch MPBetreibV
Was regelt das MPDG (auch)?
Über MPBetreibV und MPDG
Was ist neu im MPDG?
Genaue Vorgaben zu Qualifikationen für Einweisungen
Was regelte das MPG?
Pflicht für Hersteller
Was regelt das MPDG (auch)?
Fortgeführt
Was ist neu im MPDG?
Ausgedehnt auf Betriebe, die implantierbare Sonderanfertigungen der Klasse III oder Sterilisation für Dritte durchführen
Komplett neu geregelt wurden:
- Übergangsbestimmungen für das Medizinprodukteinformations- und Datenbank-system mit neuen Regelungen zu Alt-Produkten und klinischen Prüfungen und
- Sondervorschriften mit einem eigenen Kapitel für Bundeswehr, Zivil- und Katastrophenschutz
Weitere Informationen zu Genehmigungsverfahren, Ethikvoten, Antragswegen über DMIDS und aktuelle Anforderungen stellt das BfArM auf seiner Informationsseite zu klinischen Prüfungen mit Medizinprodukten bereit.
Navigieren Sie sicher durch das MPDG und die MDR!
Nutzen Sie unsere Expertise für die normgerechte Umsetzung regulatorischer Anforderungen – von der klinischen Prüfung bis zur Vigilanz. Wir unterstützen Sie bei Dokumentation, Ethikanträgen und der Rolle der PRRC – kompetent, rechtssicher und praxistauglich. Jetzt Beratung anfordern und regulatorisch auf der sicheren Seite sein!
MPDG + Verordnungen = nationaler Rahmen
Mit dem Inkrafttreten des MPDG begann eine neue Phase der nationalen Ausgestaltung europäischer Vorgaben. Denn: Die MDR ist zwar unmittelbar geltendes EU-Recht, doch zentrale Regelungsbereiche bedürfen auf nationaler Ebene der Ergänzung oder Präzisierung. Hier setzt das MPDG an – unterstützt durch eine Reihe begleitender deutscher Verordnungen, die den regulatorischen Rahmen für Hersteller, Betreiber und Anwender vollständig machen.
Zu den wichtigsten nationalen Verordnungen gehören:
- MPBetreibV (Medizinprodukte-Betreiberverordnung): Regelt u. a. die Einweisung, die Kontrolle und den sicheren Betrieb von Medizinprodukten.
- MPAMIV (Medizinprodukte-Anwendermelde- und Informationsverordnung): Präzisiert die Meldepflichten für Anwender und Betreiber bei Vorkommnissen oder Risiken im Betrieb.
- MPAV, MeMBV, MPDG-GebV: Behandeln spezifische Aspekte wie z. B. die Abgabe von Medizinprodukten, die Bewertung medizinischer Methoden oder die Gebührenstruktur bei behördlichen Verfahren.
Diese Verordnungen konkretisieren Anforderungen, die in der MDR nur allgemein oder lückenhaft geregelt sind – etwa zur Wiederaufbereitung, zur Sprachregelung (§ 8 MPDG) oder zu Einweisungen in Softwareprodukte.
Erst das Zusammenspiel aus MPDG und seinen Verordnungen schafft einen klaren Rechtsrahmen – angepasst an den deutschen Markt.
Bedeutung des MPDGs für Hersteller und Betreiber
Das MPDG stellt Hersteller, Betreiber und Dienstleister in Deutschland vor neue Herausforderungen. Wer Medizinprodukte herstellt, in Verkehr bringt, klinische Prüfungen durchführt oder als Sterilisationsdienstleister tätig ist, muss die Anforderungen aus drei Regelungsebenen zusammenführen: EU-Verordnungen (MDR/IVDR), das MPDG sowie nationale Verordnungen. Besonders bei klinischen Prüfungen und Ethikanträgen ist ein tiefes Verständnis des MPDG unerlässlich.
Bei spezifischen Fragen zu MDR-Studien – etwa zur Zuständigkeit, dem richtigen Zeitpunkt der Antragstellung über DMIDS oder zu Übergangsregelungen für bereits begonnene Studien – hat das BfArM eine kurze FAQ-Übersicht veröffentlicht.
Empfehlenswert ist die Überarbeitung bestehender Verfahrensanweisungen in den Bereichen:
- klinische Prüfungen,
- Registrierung von Herstellern und Produkten,
- Vigilanz und Meldesysteme.
Ein weiterer zentraler Punkt ist die korrekte Umsetzung der Rolle der „Person Responsible for Regulatory Compliance“ (PRRC) gemäß Artikel 15 MDR. Diese unterscheidet sich klar von der bisherigen Rolle des Sicherheitsbeauftragten. Ein bloßer Austausch der Bezeichnung reicht nicht aus und kann zu regulatorischen Verstößen führen.
Im interaktiven MDR tool gibt es auch zur PRRC wichtige Definitionen und weiterführende Verlinkungen.
Fazit
Mit dem MPDG wurde der europäische Rechtsrahmen der MDR und IVDR auf nationaler Ebene konkretisiert und das MPG vollständig abgelöst. Gemeinsam mit ergänzenden Verordnungen wie der MPBetreibV bildet es das Rückgrat des deutschen Medizinprodukterechts. Für Hersteller, Betreiber und weitere Akteure bedeutet das: strengere Anforderungen, neue Verantwortlichkeiten und höhere Sorgfaltspflichten – insbesondere bei Dokumentation, klinischen Prüfungen und Meldeprozessen. Nur wer sich aktiv mit den nationalen Ergänzungen auseinandersetzt, kann regulatorische Anforderungen vollständig und rechtskonform erfüllen.
Bereit für die neuen regulatorischen Anforderungen?
Navigieren Sie sicher durch das MPDG und die MDR!
Wir unterstützen Sie mit maßgeschneiderter Beratung und unterstützen Sie bei allen regulatorischen Anforderungen rund um Ihre Medizinprodukte – rechtssicher, normgerecht und verständlich. Nutzen Sie unser Know-how für erfolgreiche Audits, Genehmigungen und den sicheren Marktzugang Ihrer Medizinprodukte.